Sprachen Bedienungsanleitung und Gebrauchsanweisung

Artikel 10 (Allgemeine Pflichten der Hersteller) Absatz 11 Die Hersteller sorgen dafür, dass dem Produkt die Informationen gemäß Anhang I Abschnitt 23 in einer oder mehreren von dem Mitgliedstaat, in dem das Produkt dem Anwender oder Patienten zur Verfügung gestellt wird, festgelegten Amtssprache(n) der Union beiliegen. In der Europäische Union mit seinen 27 Mitgliedsländer gibt […]
CE-Konformitätskennzeichnung

CE-Kennzeichnung Die CE-Kennzeichnung erfolgt für alle Medizinprodukte gemäß Artikel 20 MDR. Der Hersteller muss das CE-Zeichen auf dem Produkt oder der Sterilverpackung, der Gebrauchsanweisung und ggf. der Handelsverpackung anbringen. Zusätzlich ist, je nach Klasse des Medizinprodukts, die Kennnummer der Benannten Stelle notwendig. Ausnahmen:Sonderanfertigungen und Prüfprodukte tragen keine CE-Kennzeichnung Mehr dazu in unseren Seminaren zum Medizinprodukteberater.
Anzeigepflicht

Anzeigepflicht Jeder Hersteller, der Medizinprodukte in Deutschland erstmalig in Verkehr bringt, muss der zuständigen Behörde die Anschrift seines Firmensitzes sowie die Bezeichnung und Beschreibung des jeweiligen Produktes mitteilen. Dies gilt auch für die nachträgliche Änderung bestehender sowie neu hinzugekommener Produkte. Diese Registrierung erfolgt online beim BfArM. Sobald einsatzbereit, erfolgt die Registrierung in der europäischen Datenbank […]
EUDAMED Datenbank

Die EUDAMED ist eine Datenbank, die noch entwickelt wird, um bestimmte Anforderungen der Verordnung (EU) 2017/745 über Medizinprodukte (MDR) und der Verordnung (EU) 2017/746 über IVDs umzusetzen. Sie wird multifunktional sein und gleichzeitig ein Registrierungssystem, ein Meldesystem und ein Verbreitungssystem (in Teilen öffentlich zugänglich), wodurch die Transparenz und die Koordination von Informationen zu Medizinprodukten auf […]
Single Registration Number (SRN)
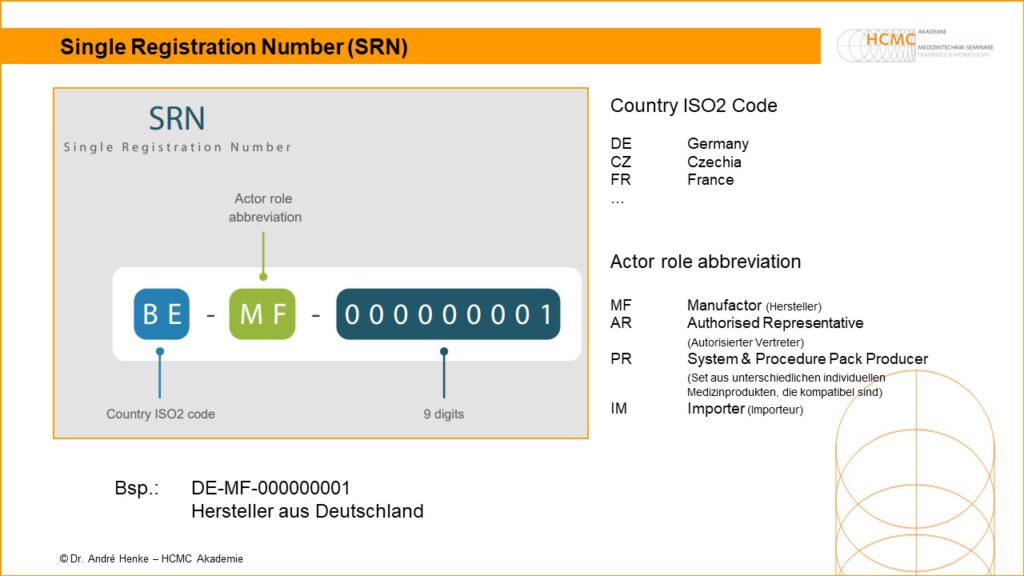
Single Registration Number Die Single Registration Number (SRN) wurde mit der MDR / IVDR verpflichtend für alle Wirtschaftsakteure eingeführt, die Medizinprodukte in der EU herstellen oder als Bevollmächtigte oder Importeure für Medizinprodukte tätig sind. Sie dient der eindeutigen Identifizierung von Wirtschaftsakteuren innerhalb der gesamten EU und erlaubt es notwendige Daten wie Name, Adresse, Kontaktdaten usw. […]
Verantwortliche Person für regulatorische Anforderungen (Artikel 15 MDR)

Der Hersteller muss „Sicherheitskorrekturmaßnahmen“ der verantwortlichen Behörde mitteilen. Die Verantwortliche Person (PRRC – Person Responsible for Regulatory Compliance) sammelt und bewertet Meldungen über Risiken von Medizinprodukten und koordiniert ggf. notwendige korrektive Maßnahmen Mehr dazu in unseren Seminaren zum Medizinprodukteberater.
Meldung von Vorkommnissen
Hersteller müssen ein Verfahren zur Produktbeobachtung einrichten, in dem sie Informationen und Erfahrungen mit ihren Produkten aus den der Herstellung nachgelagerten Phasen systematisch erfassen und auswerten. Vorkommnisse und Rückrufe – wobei unter Rückruf jede korrektive Maßnahme zu verstehen ist, die sich an die Betreiber von Medizinprodukten richtet (z. B. auch Zusatzinformationen oder Änderungen der Gebrauchsanweisung) […]
Meldeverpflichtung der Hersteller

Schwerwiegende Vorkommnisse mit Medizinprodukten müssen den Behörden gemeldet werden. In Deutschland an das BfArM bzw. PEI Im EU-Ausland an die jeweilige Behörde des EWR-Staates Mehr dazu in unseren Seminaren zum Medizinprodukteberater.
Qualitätsmanagement-System

Das Qualitätsmanagement beschreibt, wie Qualität im Unternehmen erzeugt wird bzw. wie eine gleichbleibende Qualität sichergestellt werden kann. Die Funktionsweise basiert auf einer Sammlung an Regeln, Zuständigkeiten und Prozessen, die aufeinander abgestimmt sind, sowie der Festlegung der Zuständigkeiten und Verantwortungen. Das zusammengefasst bezeichnet man als Qualitätsmanagementsystem (QMS). Die MDR schreibt vor, dass jede Firma ein QM-System […]
Post-Market Clinical Follow Up (PMCF)

Mit der MDR wurden die Aufgaben des Herstellers nach dem Verkauf des Produktes deutlich erweitert. Das „Post-Market Clinical Follow Up“ umfasst: Mehr dazu in unseren Seminaren zum Medizinprodukteberater.
