§ 83 Absatz 3 MPDG – Nachweis und Weiterbildung Sachkenntnis

(3) Der Medizinprodukteberater hat der zuständigen Behörde auf Verlangen seine Sachkenntnis nachzuweisen. Mehr dazu in unseren Seminaren zum Medizinprodukteberater.
§ 83 Absatz 4 MPDG – Aufgaben des Medizinprodukteberaters

Der Medizinprodukteberater hat Mitteilungen von Angehörigen der Fachkreise über aufzuzeichnen und unverzüglich dem Hersteller, seinem Bevollmächtigten oder deren für die Einhaltung der Regelungsvorschriften verantwortlichen Person schriftlich oder elektronisch zu übermitteln. Werden Medizinprodukte unter der Verantwortung des Importeurs in Verkehr gebracht, sind die Informationen nach Satz 1 diesem schriftlich oder elektronisch zu übermitteln. Mehr dazu in […]
Beispiele für Mitteilungen
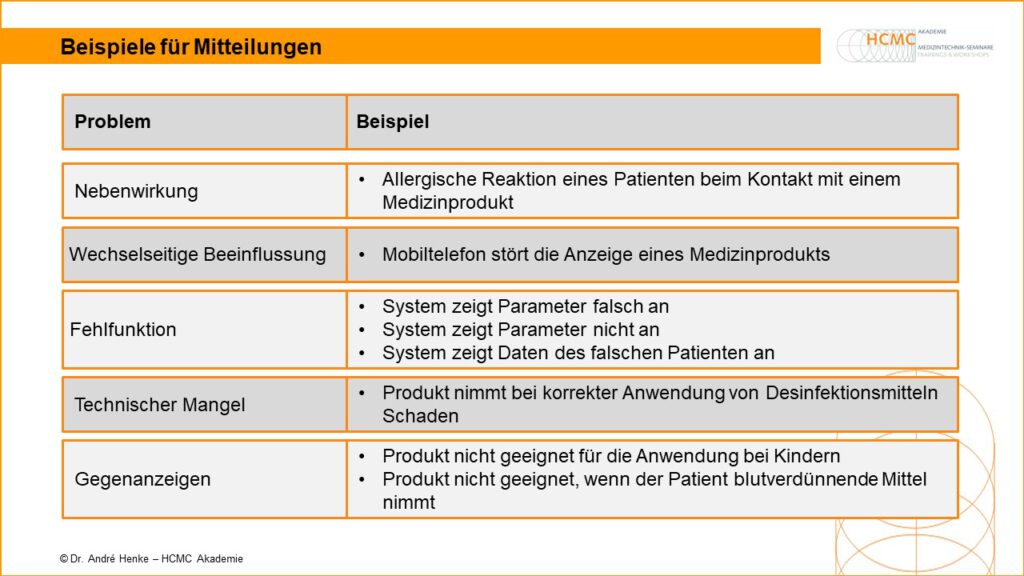
Beispiele für Meldungen über Probleme mit Medizinprodukten MDR Problem Beispiel Nebenwirkung Allergische Reaktion eines Patienten beim Kontakt mit einem Medizinprodukt Wechselseitige Beeinflussung Mobiltelefon stört die Anzeige eines Medizinprodukts Fehlfunktion • System zeigt Parameter falsch an• System zeigt Parameter nicht an• System zeigt Daten des falschen Patienten an Technischer Mangel Produkt nimmt bei korrekter Anwendung von […]
Vorkommnisse (Artikel 2 MDR)

Nur schwerwiegende Vorkommnisse sind meldepflichtig an die Behörden. Mehr dazu in unseren Seminaren zum Medizinprodukteberater.
Vigilanz-Fristen (Artikel 87 MDR)

Vigilanz-Fristen – wie schnell muss die Meldung eines schwerwiegenden Vorkommnisses an die Behörden erfolgen: Mehr dazu in unseren Seminaren zum Medizinprodukteberater.
Bereitstellen und Inverkehrbringen (Artikel 2 und 5 MDR)

„Bereitstellung auf dem Markt“ bezeichnet jede „Inverkehrbringen“ bezeichnet die erstmalige Bereitstellung eines Produkts, mit Ausnahme von Prüfprodukten, auf dem Unionsmarkt. Ein Produkt darf nur in Verkehr gebracht oder in Betrieb genommen werden, wenn es … dieser Verordnung (MDR) entspricht. Mehr dazu in unseren Seminaren zum Medizinprodukteberater.
Geltungsbereich der CE-Kennzeichnung

Geltungsbereich EWR: Der EWR (Europäischer Wirtschaftsraum) umfasst alle 27 Mitgliedstaaten der EU (ohne UK) sowie die EFTA-Mitgliedsstaaten Island, Liechtenstein und Norwegen (EFTA = European Free Trade Association). Die CE-Kennzeichnung gilt ebenfalls in der Türkei (seit 25.05.2021 Mitglied in der Zollunion mit der EU). Seit dem 26.05.2021 gilt das CE-Zeichen in der Schweiz nur noch unter […]
Produktsicherheit und Leistungsfähigkeit Medizinprodukte
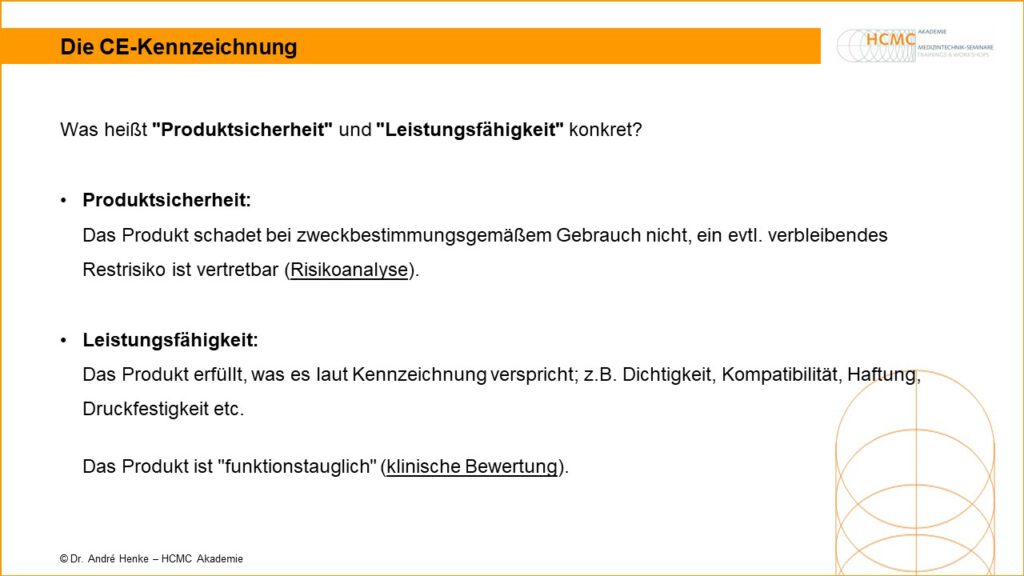
Was heißt „Produktsicherheit“ und „Leistungsfähigkeit“ konkret? Produktsicherheit:Das Produkt schadet bei zweckbestimmungsgemäßem Gebrauch nicht, ein evtl. verbleibendes Restrisiko ist vertretbar (Risikoanalyse). Leistungsfähigkeit:Das Produkt erfüllt, was es laut Kennzeichnung verspricht; z.B. Dichtigkeit, Kompatibilität, Haftung, Druckfestigkeit etc. Das Produkt ist „funktionstauglich“ (klinische Bewertung). Mehr dazu in unseren Seminaren zum Medizinprodukteberater.
Konformitätsbewertung – Benannte Stellen
Konformitätsbewertung Außer bei Produkten der Klasse I – unsteril, ohne Messfunktion oder nicht wiederverwendbar – ist eine Auditierung und Zertifizierung der Konformitätsbewertung durch eine „Benannte Stelle“ für Medizinprodukte erforderlich. Benannte Stellen Dies sind Auditierer und Zertifizierer, die nach einer speziellen Eignungsprüfung durch eine zuständige nationale Behörde – in Deutschland die ZLG (Zentralstelle der Länder für […]
Straf- und Bußgeldvorschriften
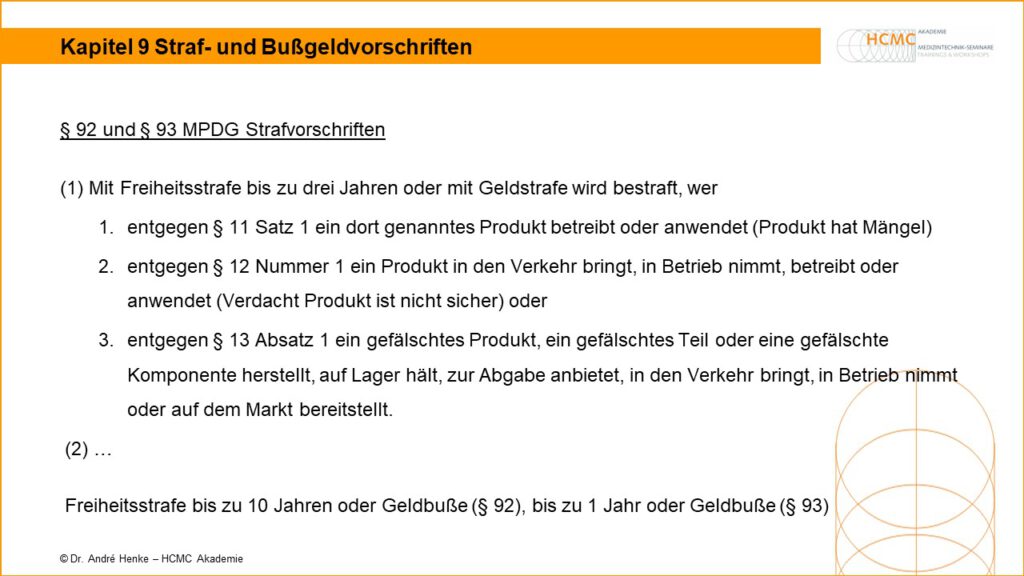
§ 92 und § 93 MPDG Strafvorschriften (1) Mit Freiheitsstrafe bis zu drei Jahren oder mit Geldstrafe wird bestraft, wer 1. entgegen § 11 Satz 1 ein dort genanntes Produkt betreibt oder anwendet (Produkt hat Mängel) 2. entgegen § 12 Nummer 1 ein Produkt in den Verkehr bringt, in Betrieb nimmt, betreibt oder anwendet (Verdacht […]
